1/8/2018
Il 15 marzo scorso la Rete dei centri europei per la farmacoepidemiologia e farmacovigilanza (ENCePP), una rete sponsorizzata dall’Agenzia Europea del Farmaco (EMA), ha pubblicato la quarta revisione del
Codice di Condotta. Il Codice ha l’obbiettivo di sostenere l’applicazione dei principi di trasparenza e indipendenza scientifica agli studi di farmaco-epidemiologia finanziati da un ente esterno, per esempio un’azienda farmaceutica.

I
farmaci vengono autorizzati al commercio e resi disponibili alla popolazione dopo che la loro efficacia e sicurezza sono stati provati sperimentalmente tramite studi clinici randomizzati. La
farmacoepidemiologia è la disciplina che si occupa di studiare i farmaci
dopo l’immissione in commercio, quando vengono assunti da molte persone, persone molto diverse da quelle su cui si conducono le sperimentazioni: più malate, più anziane o più giovani, con numerose patologie concomitanti, in gravidanza, in allattamento.
In Europa l’
EMA autorizza i farmaci al commercio e fa in modo che le nuove informazioni emerse dagli studi di farmacoepidemiologia diano luogo a decisioni coerenti con l’interesse della salute pubblica, per esempio l’inclusione di avvertenze specifiche nel foglietto illustrativo. Gli studi di farmacoepidemiologia sono condotti da istituti di ricerca pubblici (per esempio l’Agenzia regionale di sanità della Toscana) oppure privati, e, anche quando sono condotti su mandato dell’EMA, sono frequentemente finanziati dalle stesse aziende farmaceutiche che producono il farmaco o vaccino studiato. Questo crea la necessità di salvaguardare l’indipendenza scientifica dei ricercatori e di garantire la trasparenza nella conduzione degli studi, per evitare che gli interessi dei finanziatori ne condizionino le conclusioni. Nel 2008 l’EMA ha promosso la nascita del network
ENCePP, che mette insieme le competenze dei centri accademici e degli istituti di ricerca privati che conducono studi di farmacoepidemiologia. Da più di dieci anni ENCePP crea e aggiorna linee guida metodologiche ed etiche sulla conduzione degli studi.
Il
Codice di Condotta dell'ENCePP è stato aggiornato perché la versione precedente risultava di difficile lettura, e alcune raccomandazioni sembravano contraddittorie o ambigue. Nella nuova versione viene ribadita l’importanza del
registro pubblico EU PAS, dove tutti gli studi devono essere registrati prima di iniziare, e viene chiarito che lo studio va salvaguardato da tutti gli interessi in gioco intorno al prodotto studiato – siano essi commerciali, finanziari, istituzionali o personali: tutti gli interessi vanno dichiarati pubblicamente nel Registro. Tuttavia, è ora esplicitamente chiarito che il responsabile ultimo dello studio (
principal investigator) non può avere interessi commerciali, finanziari o istituzionali nel prodotto, in particolare non può essere un ricercatore impiegato dalla casa farmaceutica che finanzia lo studio: questa raccomandazione stabilisce una
separazione dei poteri tra chi finanzia lo studio, e ha quindi naturalmente una forte influenza, anche indiretta,
e chi ne ha la responsabilità scientifica. Il contratto tra istituto di ricerca e finanziatore deve specificare che la retribuzione non dipende dall’esito dello studio. Tutti i documenti fondamentali dello studio (protocollo e rapporto finale) devono essere resi pubblici nel Registro, indipendentemente dall’esito dello studio, e il protocollo deve essere registrato prima che cominci la raccolta o estrazione dei dati.
Raccomandazioni principali del Codice di Condotta per lo svolgimento di uno studio
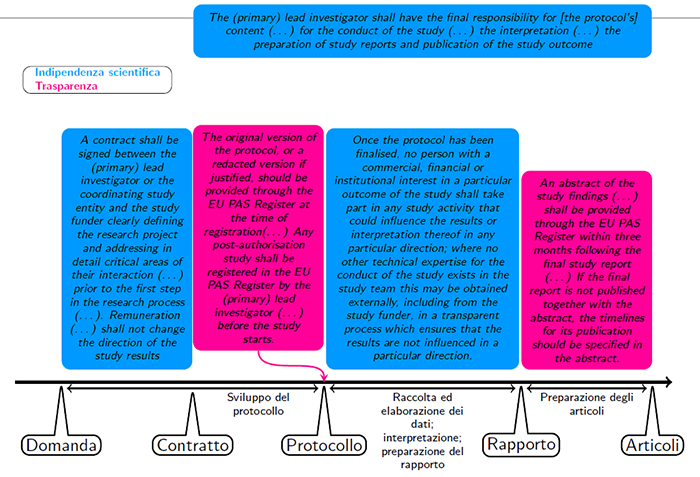
L’
ARS fa parte dell'ENCePP e
ha contribuito al gruppo di lavoro che ha formulato l’aggiornamento del Codice di Condotta. L’unità di farmaco-epidemiologia dell'ARS partecipa e conduce studi finanziati da aziende farmaceutiche, purché essi siano aderenti al Codice di Condotta ENCePP: si veda
qui la
lista degli studi caricati sul Registro EU PAS in cui l'ARS è coinvolta. In questo modo la nostra Agenzia, da un lato, mantiene competenze in grado di generare evidenze osservazionali sull’uso, l’efficacia e la sicurezza dei farmaci; dall’altro, si assicura il rispetto dei principi di trasparenza e indipendenza scientifica.
Rosa Gini
Ricercatore ARS Toscana  I farmaci vengono autorizzati al commercio e resi disponibili alla popolazione dopo che la loro efficacia e sicurezza sono stati provati sperimentalmente tramite studi clinici randomizzati. La farmacoepidemiologia è la disciplina che si occupa di studiare i farmaci dopo l’immissione in commercio, quando vengono assunti da molte persone, persone molto diverse da quelle su cui si conducono le sperimentazioni: più malate, più anziane o più giovani, con numerose patologie concomitanti, in gravidanza, in allattamento.
I farmaci vengono autorizzati al commercio e resi disponibili alla popolazione dopo che la loro efficacia e sicurezza sono stati provati sperimentalmente tramite studi clinici randomizzati. La farmacoepidemiologia è la disciplina che si occupa di studiare i farmaci dopo l’immissione in commercio, quando vengono assunti da molte persone, persone molto diverse da quelle su cui si conducono le sperimentazioni: più malate, più anziane o più giovani, con numerose patologie concomitanti, in gravidanza, in allattamento.